变构抑制剂
变构抑制剂及其应用的可能性
Allostery的历史
丹麦医生克里斯蒂安*玻尔(Christian Bohr)于1904年首次发现合作蛋白的配体附着在不同的位点上。 所谓的"玻尔效应"是一种现象,其中二氧化碳通过链接到特定位点来影响血红蛋白和氧气之间的相互作用[1]。 1961年Jacques Monod和Francois Jacob将这种调节命名为"变构"抑制,因为附着在酶表面的远处区域而不是其活性位点[2]。
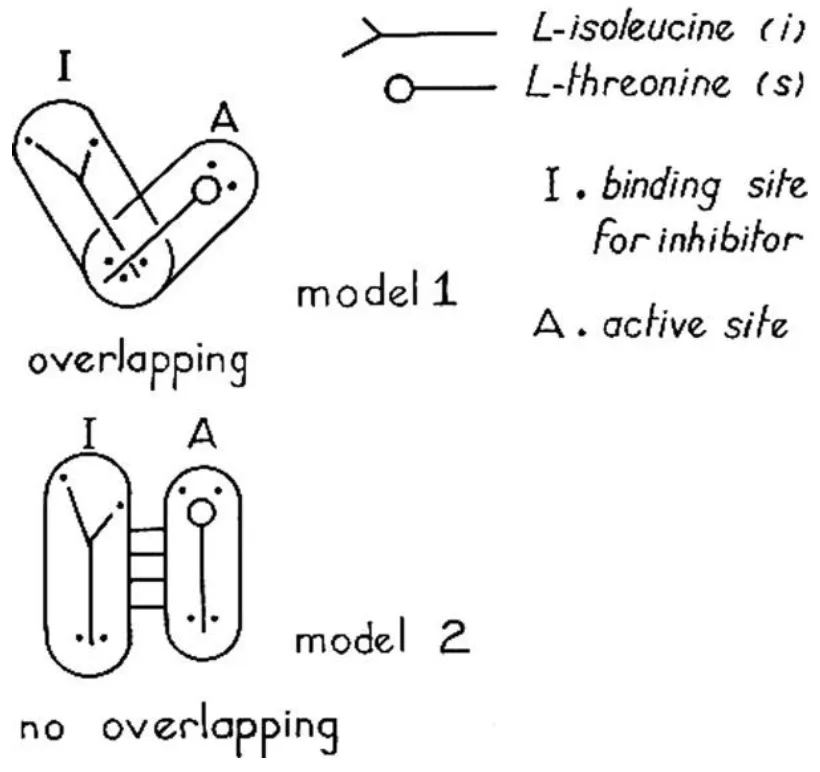
图1。 L-异亮氨酸调节L-苏氨酸脱氨酶的两种不同模型,根据Jean-Pierre Changeux[2]。 第二个模型描述了两个遥远的位点-一个用于抑制剂,一个用于底物。 后来在他们随后的出版物中,雅克*莫诺德(Jacques Monod)和弗朗索瓦*雅各布(Francois Jacob)将这种法规命名为"变构"。
变构抑制剂长期以来一直与它们所连接的蛋白质的构象变化有关。 然而,在1984年Cooper等人。 提供了一个没有任何蛋白质形状变化的变构模型。 正因为如此,异体概念包括熵贡献。 最近的研究表明,用于研究异构细胞的方法不足以断言构象转变的缺失,这意味着蛋白质状态与其变构调节之间的关系仍然不清楚。
第一种基于变构抑制剂的药物于2004年被美国FDA批准。 从那时起,这种"间接"类型的抑制一直在迅速普及[3]。 以下是变构抑制剂今天被用作药物的几例:
-
地西泮-一种用于治疗焦虑,惊恐发作,癫痫发作等的药物。;
-
Maraviroc-用于治疗HIV感染的抗病毒药物;
-
Cinacalcet-一种用于治疗甲状旁腺癌,HPT的药物。
抑制概述
如今,有很多预测变构通信的模型和工具。 不幸的是,这些预测仍然不准确,因为这种蛋白质-配体相互作用与各种调查困难有关。 为了更好地理解这种现象,让我们仔细看看已知的抑制理论依据,特别是变构抑制。
酶,或蛋白质,抑制剂是干扰催化过程和减缓酶化学变化的化合物。 酶促反应在细胞中的流行是抑制剂作为药物的普及的原因。 研究人员区分两大类抑制剂。 首先被称为可逆减缓化学反应,而不可逆完全阻止它。
另一种抑制分类是基于它们与酶的相互作用。 根据它,抑制剂可分为三个主要组:竞争性,非竞争性和混合抑制剂(表1)。
表1。 三种类型的酶抑制[4]。
|
类型 |
具竞争力
|
没有竞争力 |
混合型 |
|
绑定 |
酶戮碌录 |
酶-底物复合物 |
酶或酶-底物复合物 |
|
网站 |
Orthosteric/脥酶脮戮碌脴脥录 |
变构,变构 |
变构,变构 |
|
Scheme |
|
|
|
竞争性抑制剂在酶促表面上与底物竞争相同的相互作用区域(所谓的活性位点)。 这些抑制剂大多具有底物样分子结构。 然而,与抑制剂形成复合物的酶不能像没有抑制那样有效地催化化学转化。
非竞争性和混合抑制剂与不同于活性一个底物键的酶的远位点形成键(它也称为变构位点)。 非竞争性抑制剂在酶-底物复合物形成后与酶的远处位点相互作用。 相反,混合抑制剂可以与复合物以及酶本身相互作用。 在具有或不具有已经与其结合的底物的情况下附着于酶的亲和力取决于抑制剂而变化。 对这两种状态的亲和力相等的一组化合物被称为非竞争性抑制剂。
很明显,非竞争性和混合组抑制剂都属于更大组的变构抑制剂,但是否有任何变构竞争性抑制剂? 令人惊讶的是,是的! 与底物竞争活性位点不需要附着在其上。 实际上,一些竞争性抑制剂通过变构位点控制蛋白质状态的变化[5]。 这种抑制剂在这种情况下具有竞争性的唯一要求是,底物与酶结合不同时抑制剂与其变构位点结合。
变构与正构抑制
由于我们已经知道变构(间接)调节的基础知识,让我们将其与正构(直接到活性位点)抑制进行比较,以考虑其优势。
首先,变构抑制在如何以及何时影响酶方面具有更大的可变性。 与蛋白质表面不同的活性位点区域相互作用不仅可以完全抑制酶活性(如正构抑制的情况),而且还可以调节它[6]。 此外,许多变构调节剂在连接底物后可以与酶相互作用,而变构抑制剂需要一个自由活性位点与之结合。
其次,酶的活性位点是高度保守的。 这导致正构药物连接到具有类似活性位点的同源蛋白质而不是它们的靶标[7]。 非靶标活性不仅会降低药物的有效性,而且会导致严重的副作用。 相反,变构药物与不太保守的表面区域结合,这允许它们具有更高的特异性。
最后,大多数已知的正构抑制剂机械地阻断酶的活性位点,占据底物的相互作用位置。 如果底物浓度以某种方式增加,附着在同一部位的药物的有效性可以降低。 另一方面,变构抑制剂可以避免这种困难,其效率不受高浓度底物的影响[8]。
总而言之,变构抑制剂具有与蛋白质相互作用的不寻常方式。 在许多情况下,它们作为药物比其他抑制剂更安全,更有效的选择。 目前,它们的使用领域是巨大的-而且它正在扩大! ChemDiv的变构激酶抑制剂库包含26,000种化合物,它们是受以上讨论的所有问题限制的当前正构抑制剂的有希望的替代方案。
参考资料:
-
Liu J,Nussinov R."Allostery:其历史,概念,方法和应用概述"。 PLoS Comput Biol。 2016Jun2;12(6):e1004966。
-
Changeux,J.-P."L-异亮氨酸生物合成L-苏氨酸脱氨酶的反馈控制机制"。 冷泉港定量生物学研讨会. 1961;26(0), 313–318.
-
Wenthur CJ,Gentry PR,Mathews TP,Lindsley CW。 受体上变构位点的药物"。 Annu Rev Pharmacol毒理学。 2014;54:165-84.
-
Nelson,D.L.,&Cox,M.M."lehninger生物化学原理"(7th ed。). 2017.W.H.弗里曼。
-
Alphey MS,Pirrie L,Torrie LS,Boulkeroua WA,Gardiner M,Sarkar A,Maringer M,Oehlmann W,Brenk R,Scherman MS,McNeil M,Rejzek M,Field RA,Singh M,Gray D,Westwood NJ,Naismith JH。 "来自铜绿假单胞菌的葡萄糖-1-磷酸胸苷酰转移酶(RmlA)的变构竞争性抑制剂"。 ACS Chem Biol. 2013Feb15;8(2):387-96。
-
Nussinov R,Tsai CJ。 "特异性在正构和变构药物中起作用的不同方式"。 Curr Pharm Des. 2012;18(9):1311-6.
-
格罗弗AK。 "变构靶点在发现更安全药物中的用途"。 Med Princ Pract. 2013;22(5):418-26.
-
Verma S,Pandey AK。 "槲皮素对SARS-CoV-2主要蛋白酶的变构抑制机制的事实见解:an in silico analysis"。 3生物技术。 2021Feb;11(2):67。