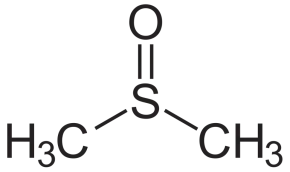
极光激酶
Aurora激酶:分类、功能和抑制剂设计
在果蝇(也称为果蝇)的着丝粒循环筛选过程中,发现了所谓的极光激酶家族中的第一种蛋白激酶。 这种蛋白质的突变引起了类似北极的单极纺锤体的发展,而不是在细胞周期中中心体的解偶联。 这就是为什么蛋白质被命名为"极光"的原因[1]。
由于极光激酶参与有丝分裂细胞分裂的不同物种之间的发现这个家族的蛋白质成为许多研究人员感兴趣的对象。 发现Aurora激酶的过表达和基因扩增与多种癌症强烈相关:胃癌,乳腺癌,卵巢癌和其他肿瘤[1]。 正因为如此,这种蛋白激酶家族的成员成为新的治疗靶点,并且极光抑制剂被证明可以有效地降低癌症活性。
Aurora文库由可能抑制Aurora激酶的小分子组成。 为了正确地进行抑制剂的设计,应考虑对该家族蛋白质进行分类。 如今,可以鉴定哺乳动物物种中已知的三类极光激酶:
-
Aurora激酶A(也称为Aurora A,AURKA,Aurora2)
-
Aurora激酶B(也称为Aurora B,AURKB,Aurora1)
-
Aurora激酶C(也称为Aurora C,AURKC,Aurora3)
让我们仔细看看Aurora家族中每个类别的结构方面,在细胞过程和癌症发展中的作用。
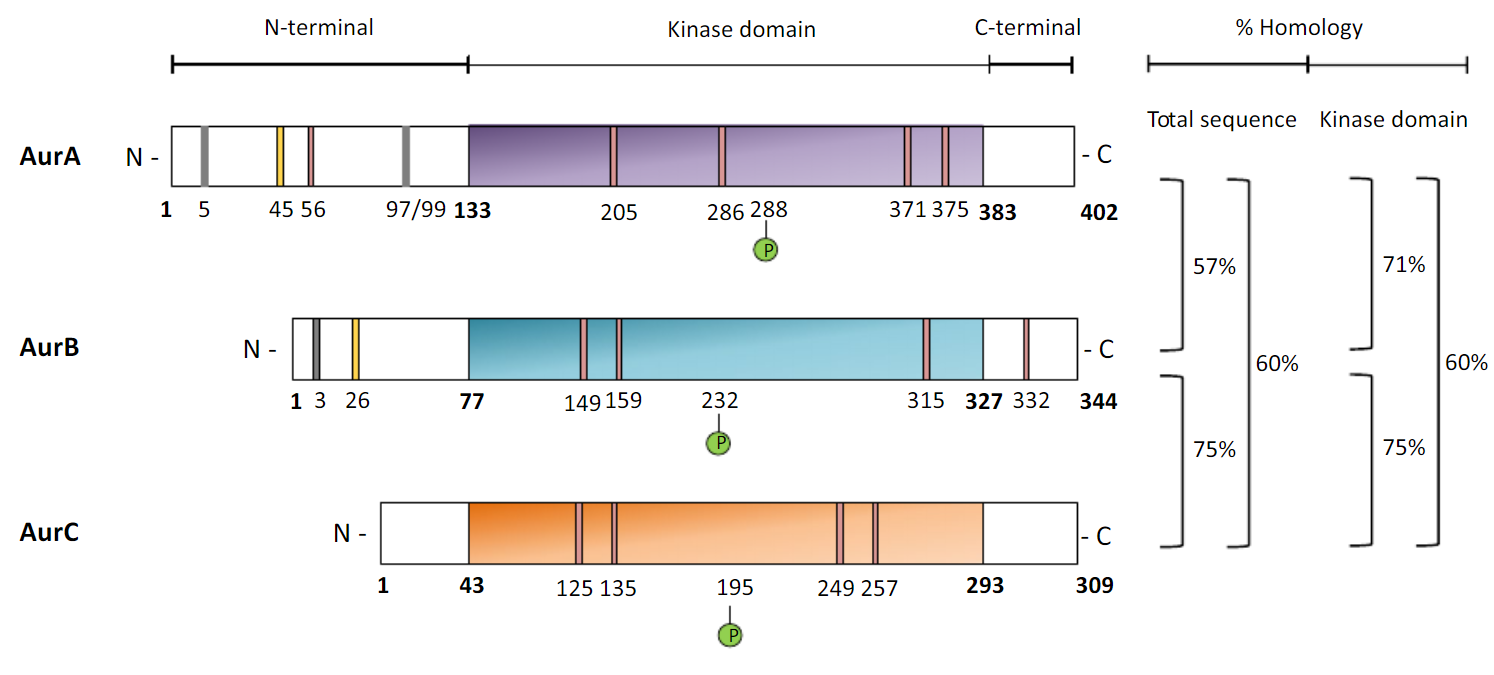
图1。 Aurora激酶结构单元[2]。
奥罗拉A
Aurora a激酶具有三个不同的功能结构单元或所谓的结构域:C-末端单元和激酶单元,它们在所有三个类中高度保守,N-末端单元具有多种长度并且类间很少或没有相似性。 负责大部分极光激酶活性的极光A激酶结构单元与极光B激酶单元具有71%的同源性和与极光C激酶单元具有60%的同源性。 残基Thr288的磷酸化导致构象变化,其允许蛋白质打开其激酶活性[2]。
蛋白质的其它构象变化包括c端和N端结构域折叠以形成蛋白质的结合位点。 值得注意的是,AURKA在腺苷和激酶结构单元的铰链之间具有特定的氢键,可用于开发Aurora a特异性抑制剂。
关于AURKA在细胞中的定位,这种蛋白质通常位于中心体附近。 Aurora A主要在细胞周期的晚期G2和晚期S阶段具有活性,并且在有丝分裂中具有其峰值活性[3]。 存在与蛋白质相关的几种功能,其包括:中心体成熟、表观遗传学、抑制肿瘤组装、纺锤体组装、有丝分裂进入调节等。
Aurora A的过表达发生在几乎所有类型的肿瘤中-它在33种癌症类型中的29种中发现。 根据不同的研究,这种过表达导致基因组和染色体不稳定,抗凋亡作用和上皮-间充质转变。 即使细胞的DNA受损,它也会刺激细胞分裂,从而导致生物体内异常细胞过多[4]。
极光B
Aurora B是Aurora家族的成员之一,也有三个结构单元,除了N末端单元外,所有这些单元都与Aurora A的单元同源。另一方面,Aurora A N末端单元短得多-Aurora A N末端单元几乎是Aurora B N末端单元的两倍。 AURKB的N末端单元还包含一个启动子,转录因子如E2F1,E2F4,FOXM1或DP2可以与之结合以调节AURKB转录[5]。 像AURKA一样,AURKB有一个残基-Thr232-在磷酸化后改变蛋白质的构象。
作为染色体乘客蛋白的Aurora激酶B的细胞定位因细胞周期的当前阶段而异。 通过纺锤体和星体微管运输,它也存在于细胞质和赤道细胞皮层中。
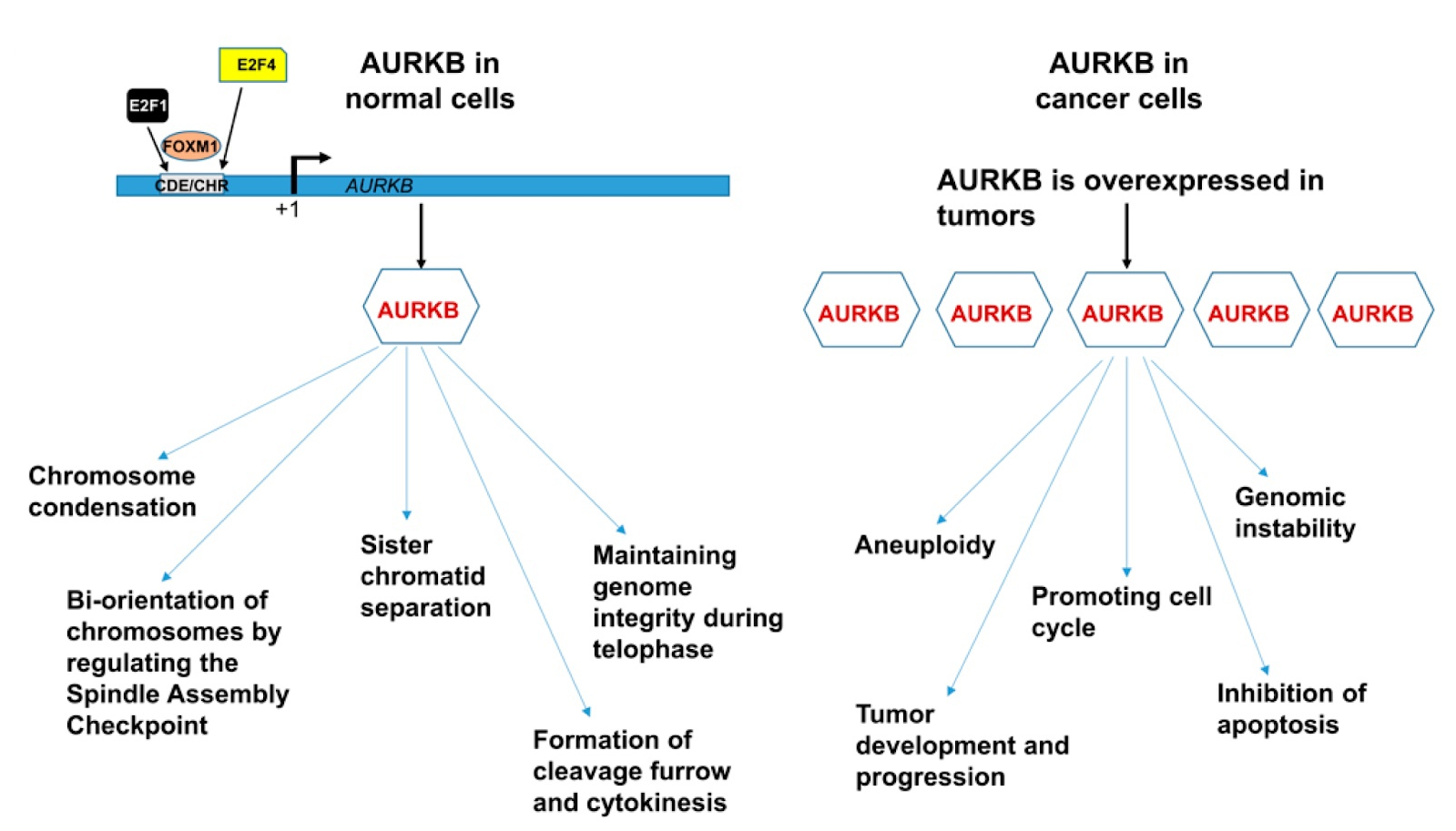
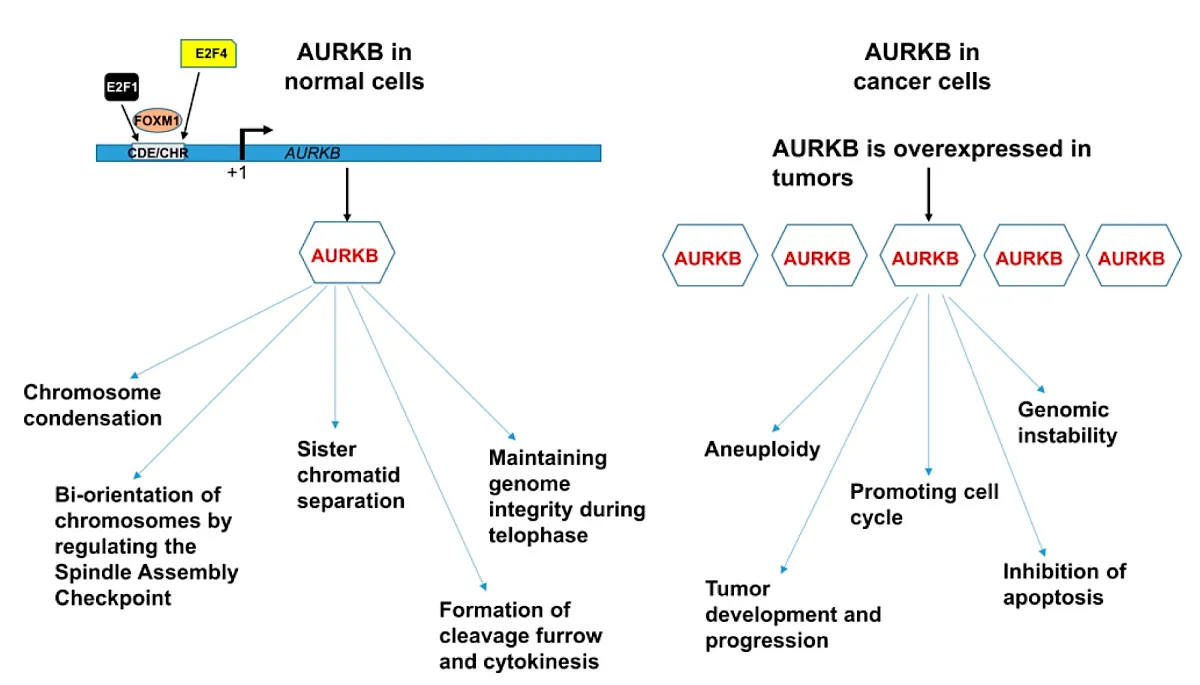
图2。 Aurora激酶B在生物过程和癌症发展中的作用[5]。
AURKB在正常细胞中的功能及其在癌细胞中的作用如上图所示。 发现肿瘤中的Aurora B与其他几种致癌基因和肿瘤抑制因子相互作用,包括Myc致癌基因,Bcr-Abl oncoprotein,细胞周期蛋白K和p53依赖性肿瘤抑制因子FBXW7。
极光C
Aurora C具有类似于Aurora A和Aurora B的三结构域结构.然而,由于替代剪接其N末端结构域作为下图中所示的三个变体之一存在。
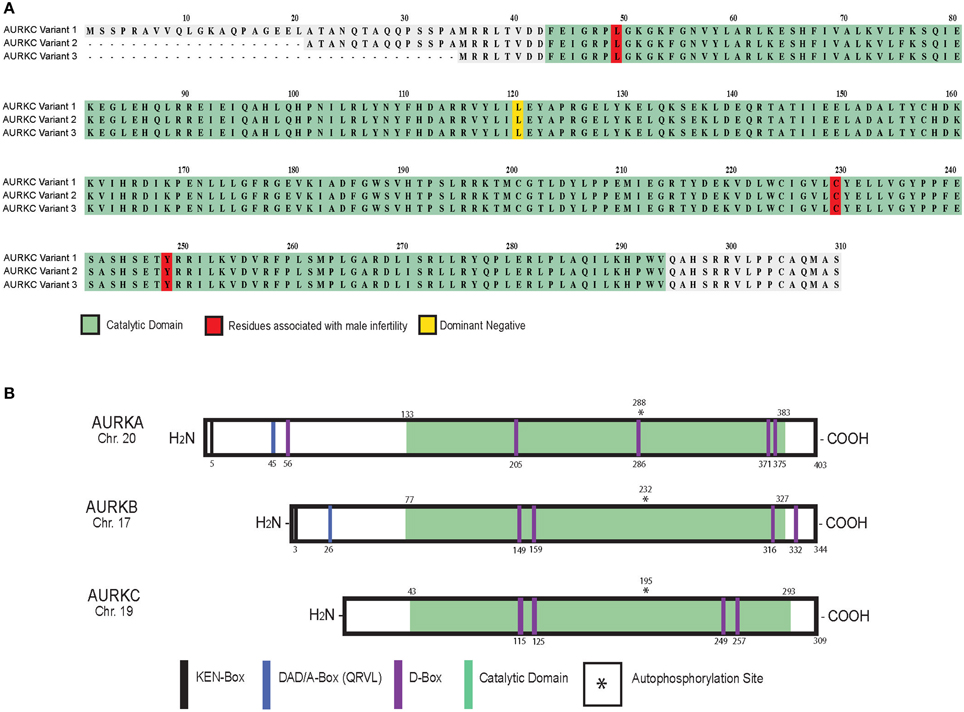
图3。 AURKC的变体[6]。
Aurora C的催化激酶结构单元与Aurora A激酶结构单元具有60%的同源性,如前所述,与Aurora B激酶结构单元具有相当高的75%同源性[2]。 这可以解释为什么Aurora B和C都与相同的内着丝粒蛋白(INCENP)相互作用,并且在生物过程中具有相似的功能。
有趣的是,虽然Aurora A和Aurora B几乎存在于生物体的每个细胞中,但在经过减数分裂(精子和卵母细胞)的细胞中发现了相当多的Aurora C蛋白表达。 AURKC功能取决于当前定位和细胞周期的相位。 大多数已知的极光C激酶功能与极光B激酶的功能重叠[6]。
不幸的是,直到今天对癌症和Aurora C激酶功能之间的联系知之甚少,尽管在一些肿瘤中检测到高水平的Aurora C表达。
极光抑制剂
大多数Aurora抑制剂被设计用于抑制Aurora A或Aurora B激酶。 原因是因为有更多关于他们参与癌症发展的信息,以及他们的功能和构象。 在这里,我们将回顾最流行的极光抑制剂,它们的靶点和作用机制。
表1。 Aurora抑制剂[5,7]及其靶标。
|
Aurora inhibitor |
Aurora A |
Aurora B |
Aurora C |
|
Barasertib (AZD1152) |
- |
+ |
- |
|
Alisertib (MLN8237) |
+ |
- |
- |
|
Hesperadin |
- |
+ |
- |
|
Danusertib (PHA-739358) |
+ |
+ |
+ |
|
PF-03814735 |
+ |
+ |
- |
|
AMG900 |
+ |
+ |
+ |
|
SP-96 |
- |
+ |
- |
|
GSK1070916 |
- |
+ |
+ |
|
AT9283 |
+ |
+ |
- |
|
CYC116 |
+ |
+ |
- |
ChemDiv可以提供含有10000种化合物的Aurora a-B激酶靶向文库,与报道的Aurora抑制剂相比,它们表现出相似的结合模式。
参考资料:
-
Fu J,Bian M,Jiang Q,Zhang C."极光激酶在有丝分裂和肿瘤发生中的作用"。 Mol Cancer Res.2007Jan;5(1):1-10。
-
Willems E,Dedobbeleer M,Digregorio M,Lombard A,Lumapat PN,Rogister B."极光激酶的功能多样性:全面综述"。 单元格Div。 2018九月19;13:7.
- Naso FD,Boi D,Ascanelli C,Pamfil G,Lindon C,Paiardini A,Guarguaglini G."Aurora-A的核定位:其对Aurora-a在癌症中的功能的调节和意义"。 癌基因。
-
Mou PK,Yang EJ,Shi C,Ren G,Tao S,Shim JS。 "Aurora激酶A,精确癌症医学的合成致死靶标"。 Exp Mol Med. 2021May;53(5):835-847。
-
Borah NA,Reddy MM."极光激酶B抑制:癌症的潜在治疗策略"。 分子。 2021Apr1;26(7):1981。
-
Quartuccio SM,Schindler K."Aurora激酶C在减数分裂和癌症中的功能"。 前细胞Dev Biol。 2015八月20;3:50.
-
Bavetsias V,Linardopoulos S."极光激酶抑制剂:现状和展望"。 前癌。 2015Dec21;5:278。