Inhibidores alostéricos
Inhibidores alostéricos y posibilidades de su aplicación
Historia de la alosteria
El primer descubrimiento conocido de ligandos de una proteína cooperativa que se unen a diferentes sitios fue realizado por el médico danés Christian Bohr en 1904. El llamado" efecto Bohr " es un fenómeno en el que el dióxido de carbono afecta la interacción entre la hemoglobina y el oxígeno al unirse al sitio específico [1]. En 1961 Jacques Monod y Francois Jacob llamaron a este tipo de inhibición de regulación "alostérica" debido a que se adhiere al área distante en la superficie enzimática en lugar de a su sitio activo [2].
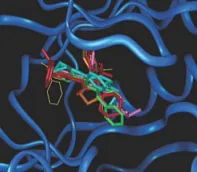
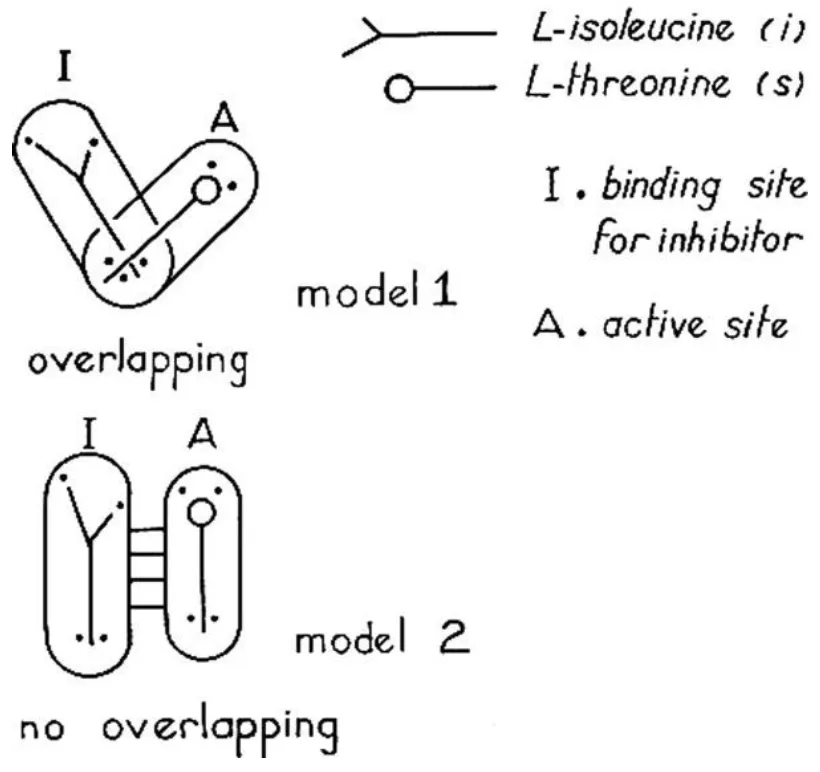
Figura 1. Dos modelos diferentes de regulación de L-treonina desaminasa por L-isoleucina, según Jean-Pierre Changeux [2]. El segundo modelo describió dos sitios distantes, uno para el inhibidor y otro para el sustrato. Más tarde, en su publicación posterior, Jacques Monod y Francois Jacob llamaron a este tipo de regulación "alostérica".
El primer medicamento basado en un inhibidor alostérico fue aprobado por la FDA de los Estados Unidos en 2004. Desde entonces, este tipo de inhibición" indirecta " ha ido creciendo en popularidad rápidamente [3]. Aquí hay varios casos de inhibidores alostéricos que se usan como medicamentos en la actualidad:
-
Diazepam: un medicamento utilizado para tratar la ansiedad, los ataques de pánico,las convulsiones, etc.;
- Maraviroc: un medicamento antiviral utilizado para tratar la infección por VIH;
- Cinacalcet-un medicamento utilizado para tratar el carcinoma de paratiroides, HPT.
Descripción general de la inhibición
Los inhibidores de enzimas, o proteínas, son compuestos químicos que interfieren con el proceso de catálisis y ralentizan los cambios químicos enzimáticos. La prevalencia de reacciones enzimáticas en las células es la razón de la popularidad del uso de inhibidores como fármacos. Los investigadores distinguen dos clases principales de inhibidores. El primero se llama reversible para ralentizar una reacción química, mientras que el irreversible la detiene por completo.& nbsp; < br>
Otra clasificación de inhibición se basa en su interacción con una enzima. Según él, los inhibidores se pueden dividir en tres grupos principales: inhibidores competitivos, no competitivos y mixtos (tabla 1).
Cuadro 1. Tres tipos de inhibición enzimática [4].
Tipo
Competitivo
Poco Competitivo
Mixto
Unir
Enzima
Complejo enzima-sustrato
Enzima o complejo enzima-sustrato
Sitio
Ortostérico / alostérico
Alostérico
Alostérico
Esquema
Los inhibidores competitivos compiten con el sustrato por la misma área de interacción (el llamado sitio activo) en la superficie enzimática. La mayoría de estos inhibidores tienen una estructura molecular similar a un sustrato. Sin embargo, la enzima, que forma un complejo con un inhibidor, no puede catalizar transformaciones químicas tan eficazmente como lo haría sin inhibición.
Los inhibidores mixtos y no competitivos forman enlaces con un sitio distante de la enzima diferente del activo con el que se une el sustrato (también se llama sitio alostérico). Los inhibidores no competitivos interactúan con el sitio distante de una enzima después de que se forma el complejo enzima-sustrato. Los inhibidores mixtos, por el contrario, pueden interactuar con el complejo, así como con la enzima misma. La afinidad para unirse a la enzima con o sin el sustrato ya unido a ella varía dependiendo del inhibidor. El grupo de compuestos químicos en los que la afinidad por ambos estados es igual se conoce como inhibidores no competitivos.
Está claro que tanto los grupos de inhibidores no competitivos como los mixtos pertenecen a un grupo más grande de inhibidores alostéricos, pero ¿existen inhibidores competitivos alostéricos? Sorprendentemente, sí! Competir por un sitio activo con sustrato no requiere unirse a él. En realidad, algunos inhibidores competitivos controlan los cambios de los estados de las proteínas a través del sitio alostérico [5]. El único requisito para que este tipo de inhibidor sea competitivo en este caso es que el sustrato no esté unido a una enzima al mismo tiempo que el inhibidor está unido a su sitio alostérico.& nbsp;
Inhibición alostérica frente a ortostérica
Como ya conocemos los conceptos básicos de la regulación alostérica (indirecta), comparémosla con la inhibición ortostérica (directamente al sitio activo) para considerar sus ventajas.
Para empezar, la inhibición alostérica tiene más variabilidad en cómo y cuándo afecta a una enzima. La interacción con un área de sitio diferente de la activa de una superficie de proteína puede no solo inhibir completamente la actividad enzimática( como en el caso de la inhibición ortostérica), sino también modularla [6]. Además, muchos moduladores alostéricos pueden interactuar con una enzima después de conectar el sustrato, mientras que los inhibidores ortostéricos necesitan un sitio activo libre para unirse.
En segundo lugar, el sitio activo de una enzima es altamente conservador. Esto conduce a fármacos ortostéricos que se conectan a proteínas homólogas con un sitio activo similar en lugar de su diana [7]. La actividad no diana no solo reduce la eficacia de un fármaco, sino que también puede provocar efectos secundarios graves. Por el contrario, los fármacos alostéricos se unen a regiones superficiales menos conservadoras, lo que les permite tener una mayor especificidad.
Finalmente, la mayoría de los inhibidores ortostéricos conocidos bloquean mecánicamente un sitio activo de una enzima, ocupando el lugar de interacción de un sustrato. Si la concentración de sustrato aumenta de alguna manera, la eficacia de los fármacos que se unen al mismo sitio puede reducirse. Los inhibidores alostéricos, por otro lado, pueden evitar tales dificultades, y su eficacia no se ve afectada por una alta concentración de sustrato [8].
En resumen, los inhibidores alostéricos tienen una forma inusual de interacción con las proteínas. Son, en muchos casos, una opción más segura y eficaz como fármacos que otros inhibidores. Actualmente, su área de uso es enorme, ¡y se está expandiendo! La Biblioteca de Inhibidores de Quinasas Alostéricas de ChemDiv contiene 26.000 compuestos, que son una alternativa prometedora a los inhibidores ortostéricos actuales limitados por todos los problemas discutidos anteriormente.
Referencias:
-
Liu J, Nussinov R. "Alosterio: Una descripción general de Su Historia, Conceptos, Métodos y Aplicaciones". PLoS Comput Biol. 2 de junio de 2016;12 (6): e1004966.& nbsp;
Changeux, J.-P. "El Mecanismo de Control de Retroalimentación de la L-Treonina Desaminasa Biosintética por L-Isoleucina". Simposios de Biología Cuantitativa de Cold Spring Harbor. 1961;26(0), 313–318.& nbsp;
< li>Wenthur CJ, Gentry PR, Mathews TP, Lindsley CW. "Fármacos para sitios alostéricos en receptores". Annu Rev Pharmacol Toxicol. 2014;54:165-84.
< li > Nelson, DL ,y Cox, MM "Principios de bioquímica de Lehninger" (7a ed.). 2017.W. H. Freeman.
Alphey MS, Pirrie L, Torrie LS, Boulkeroua WA, Gardiner M, Sarkar A, Maringer M, Oehlmann W, Brenk R, Scherman MS, McNeil M, Rejzek M, Field RA, Singh M, Gray D, Westwood NJ, Naismith JH. "Inhibidores competitivos alostéricos de la glucosa-1-fosfato timidililtransferasa (RmlA) de Pseudomonas aeruginosa". ACS Chem Biol. 15 de febrero de 2013;8 (2): 387-96.
< li>Nussinov R, Tsai CJ. "Las diferentes formas a través de las cuales funciona la especificidad en fármacos ortostéricos y alostéricos". Curr Pharm Des. 2012;18(9):1311-6.