Inhibiteurs allostériques
Inhibiteurs allostériques et possibilités de leur application
Histoire de l'allosterie
La première découverte connue de ligands d'une protéine coopérative se fixant à différents sites a été faite par le médecin danois Christian Bohr en 1904. Le soi-disant « effet Bohr » est un phénomène dans lequel le dioxyde de carbone affecte l'interaction entre l'hémoglobine et l'oxygène en se liant au site spécifique. 1]. En 1961, Jacques Monod et François Jacob ont nommé ce type de régulation inhibition « allostérique » en raison de l'attachement à la zone distante sur la surface enzymatique plutôt qu'à son site actif [2].
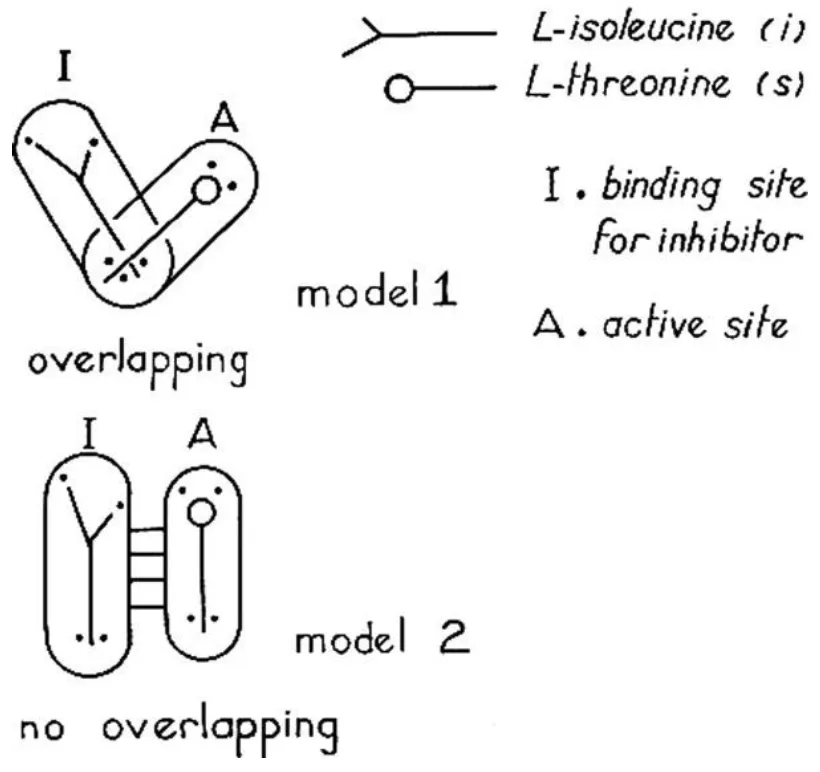
Figure 1. Deux modèles différents de régulation de la L-thréonine désaminase par la L-isoleucine, selon Jean-Pierre Changeux [2]. Le deuxième modèle décrit deux sites distants - un pour l'inhibiteur et un pour le substrat. Plus tard dans leur publication ultérieure, Jacques Monod et François Jacob ont nommé ce type de régulation « allostérique ».
Le premier médicament basé sur un inhibiteur allostérique a été approuvé par la FDA américaine en 2004. Depuis lors, ce type d'inhibition "indirecte" a rapidement gagné en popularité [3]. Voici plusieurs cas d'inhibiteurs allostériques utilisés comme médicaments aujourd'hui :
- Diazépam - un médicament utilisé pour traiter l'anxiété, les attaques de panique, les convulsions, etc. ;
- Maraviroc - un médicament antiviral utilisé pour traiter l'infection par le VIH ;
- Cinacalcet - un médicament utilisé pour traiter le carcinome parathyroïdien, HPT.
Aperçu de l'inhibition
Les inhibiteurs d'enzymes ou de protéines sont des composés chimiques qui interfèrent avec le processus de catalyse et ralentissent les changements chimiques enzymatiques. La prévalence des réactions enzymatiques dans les cellules est la raison de la popularité de l'utilisation des inhibiteurs comme médicaments. Les chercheurs distinguent deux classes principales d'inhibiteurs. Le premier est appelé réversible pour ralentir une réaction chimique, tandis que l'irréversible l'arrête complètement.
Une autre classification d'inhibition est basée sur leur interaction avec une enzyme. Selon elle, les inhibiteurs peuvent être divisés en trois groupes principaux : les inhibiteurs compétitifs, non compétitifs et mixtes (tableau 1).
Tableau 1. Trois types d'inhibition enzymatique [4].
Taper
Compétitif
Non compétitif
Mixte
Se lie
Enzyme
Complexe enzyme-substrat
Enzyme ou complexe enzyme-substrat
Placer
Orthostérique/allostérique
allostérique
allostérique
Schème
Les inhibiteurs compétitifs sont en compétition avec le substrat pour la même zone d'interaction (appelée site actif) sur la surface enzymatique. La plupart de ces inhibiteurs ont une structure moléculaire de type substrat. Cependant, l'enzyme, formant un complexe avec un inhibiteur, ne peut catalyser les transformations chimiques aussi efficacement qu'elle le serait sans inhibition.
Les inhibiteurs non compétitifs et mixtes forment des liaisons avec un site distant de l'enzyme différent du substrat actif avec lequel se lie (il est également appelé site allostérique). Les inhibiteurs non compétitifs interagissent avec le site distant d'une enzyme après la formation du complexe enzyme-substrat. Les inhibiteurs mixtes, en revanche, peuvent interagir avec le complexe ainsi qu'avec l'enzyme elle-même. Une affinité pour se fixer à l'enzyme avec ou sans le substrat déjà lié à celle-ci varie en fonction de l'inhibiteur. Le groupe de composés chimiques dans lesquels l'affinité pour ces deux états est égale est appelé inhibiteurs non compétitifs.
Il est clair que les groupes d'inhibiteurs non compétitifs et mixtes appartiennent à un groupe plus large d'inhibiteurs allostériques, mais existe-t-il des inhibiteurs compétitifs allostériques ? Étonnamment, oui! La compétition pour un site actif avec un substrat ne nécessite pas de s'y attacher. En fait, certains inhibiteurs compétitifs contrôlent les changements d'états protéiques via le site allostérique [5]. La seule exigence pour qu'un tel type d'inhibiteur soit compétitif dans ce cas est que le substrat ne soit pas lié à une enzyme en même temps que l'inhibiteur est lié à son site allostérique.
Inhibition allostérique vs orthostérique
Puisque nous connaissons déjà les bases de la régulation allostérique (indirecte), comparons-la à l'inhibition orthostérique (directement au site actif) pour considérer ses avantages.
Pour commencer, l'inhibition allostérique a plus de variabilité dans la manière et le moment où elle affecte une enzyme. L'interaction avec une surface différente du site actif d'une protéine peut non seulement inhiber complètement l'activité enzymatique (comme dans le cas de l'inhibition orthostérique), mais aussi la moduler [6]. De plus, de nombreux modulateurs allostériques peuvent interagir avec une enzyme après la connexion du substrat, tandis que les inhibiteurs orthostériques ont besoin d'un site actif libre pour se lier.
Deuxièmement, le site actif d'une enzyme est très conservateur. Cela conduit à des médicaments orthostériques se connectant à des protéines homologues avec un site actif similaire au lieu de leur cible [7]. L'activité non ciblée réduit non seulement l'efficacité d'un médicament, mais peut également entraîner des effets secondaires graves. Au contraire, les médicaments allostériques se lient à des régions de surface moins conservatrices, ce qui leur permet d'avoir une spécificité plus élevée.
Enfin, la plupart des inhibiteurs orthostériques connus bloquent mécaniquement un site actif d'une enzyme, occupant la place d'interaction d'un substrat. Si la concentration du substrat est augmentée d'une manière ou d'une autre, l'efficacité des médicaments se fixant au même site peut être réduite. Les inhibiteurs allostériques, en revanche, peuvent éviter de telles difficultés et leur efficacité n'est pas affectée par une concentration élevée de substrat [8].
En résumé, les inhibiteurs allostériques ont une façon inhabituelle d'interagir avec les protéines. Ils sont, dans de nombreux cas, une option plus sûre et plus efficace que les autres inhibiteurs. Actuellement, leur domaine d'utilisation est immense – et il s'étend ! La bibliothèque d'inhibiteurs de kinases allostériques de ChemDiv contient 26 000 composés, qui constituent une alternative prometteuse aux inhibiteurs orthostériques actuels limités par tous les problèmes évoqués ci-dessus.
Références :
- Liu J, Nussinov R. "Allostery : Un aperçu de son histoire, de ses concepts, de ses méthodes et de ses applications". PLoS Comput Biol. 2016 juin 2;12(6):e1004966.
- Changeux, J.-P. "Le mécanisme de contrôle de rétroaction de la L-thréonine désaminase biosynthétique par la L-isoleucine". Colloques de Cold Spring Harbor sur la biologie quantitative. 1961;26(0), 313–318.
- Wenthur CJ, Gentry PR, Mathews TP, Lindsley CW. "Médicaments pour les sites allostériques sur les récepteurs". Annu Rev Pharmacol Toxicol. 2014;54:165-84.
- Nelson, D. L., & ; Cox, MM "Principes de biochimie de Lehninger" (7e éd.). 2017.W.H. Homme libre.
- Alphey MS, Pirrie L, Torrie LS, Boulkeroua WA, Gardiner M, Sarkar A, Maringer M, Oehlmann W, Brenk R, Scherman MS, McNeil M, Rejzek M, Field RA, Singh M, Gray D, Westwood NJ , Naismith JH. "Inhibiteurs compétitifs allostériques de la glucose-1-phosphate thymidylyltransférase (RmlA) de Pseudomonas aeruginosa". ACS Chem Biol. 15 février 2013 ;8(2):387-96.
- Nussinov R, Tsai CJ. "Les différentes façons dont la spécificité fonctionne dans les médicaments orthostériques et allostériques". Curr Pharm Des. 2012;18(9):1311-6.
- Goverr AK. "Utilisation de cibles allostériques dans th la découverte de médicaments plus sûrs ». Med Princ Pract. 2013;22(5):418-26.
- Verma S, Pandey AK. "Aperçus factuels du mécanisme d'inhibition allostérique de la protéase principale du SRAS-CoV-2 par la quercétine : une analyse in silico". 3 Biotech. 2021 février ;11(2):67.