Kinases Aurora

Aurora kinases : classification, fonctions et conception des inhibiteurs
La première protéine kinase d'une nouvelle famille de kinases dites Aurora a été détectée lors du dépistage du cycle centromère chez les mouches des fruits, également connues sous le nom de Drosophila melanogaster. Des mutations dans cette protéine ont provoqué le développement de fuseaux monopolaires ressemblant au pôle Nord au lieu du découplage du centrosome au cours du cycle cellulaire. C'est la raison pour laquelle la protéine a reçu le nom "Aurora" [1].
Depuis la découverte de la participation des kinases Aurora dans la division cellulaire de la mitose chez différentes espèces, cette famille de protéines est devenue un objet d'intérêt pour de nombreux chercheurs. Il a été découvert que la surexpression et l'amplification génique des kinases Aurora sont fortement associées à de multiples cancers : cancer gastrique, cancer du sein, cancer de l'ovaire et autres tumeurs [1]. Pour cette raison, les membres de cette famille de protéines kinases sont devenus de nouvelles cibles thérapeutiques, et il a été prouvé que les inhibiteurs d'Aurora réduisent efficacement l'activité du cancer.
Les bibliothèques Aurora sont constituées de petites molécules qui peuvent potentiellement inhiber les kinases Aurora. Pour mener à bien la conception des inhibiteurs, la classification de cette famille de protéines doit être envisagée. De nos jours, trois classes connues de kinases Aurora chez les espèces de mammifères peuvent être identifiées :
-
Aurora kinase A (également connue sous le nom d'Aurora A, AURKA, Aurora 2)
-
Aurora kinase B (également connue sous le nom d'Aurora B, AURKB, Aurora 1)
-
Aurora kinase C (également connue sous le nom d'Aurora C, AURKC, Aurora 3)
Examinons de plus près les aspects structurels, le rôle dans les processus cellulaires et le développement du cancer de chaque classe de la famille Aurora.
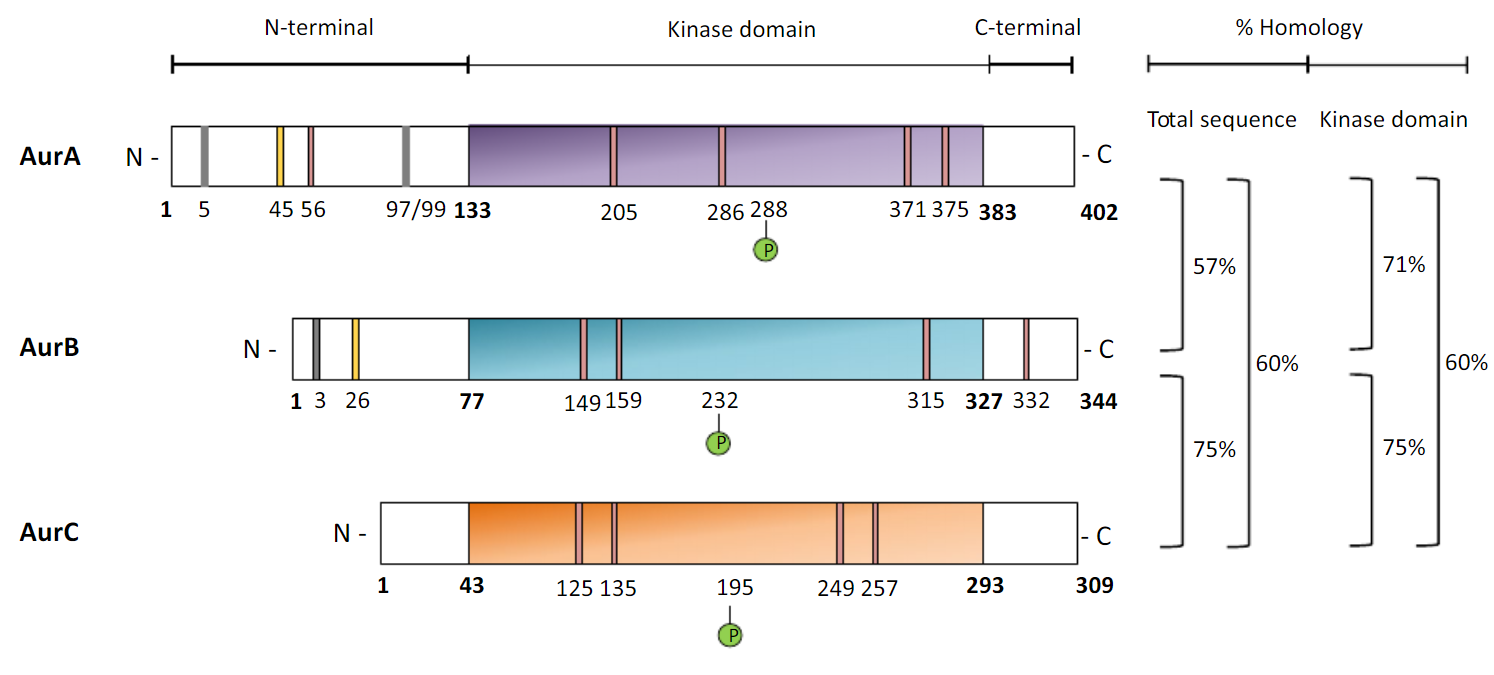
Figure 1. Unités structurelles de la kinase Aurora [2].
Aurore A
Aurora A kinase a trois unités structurelles fonctionnelles distinctes ou soi-disant domaines : l'unité C-terminale et l'unité kinase, qui sont très conservatrices parmi les trois classes, et l'unité N-terminale avec une variété de longueur et peu ou pas de similitude entre les classes . L'unité structurelle Aurora A kinase, responsable de la majeure partie de l'activité Aurora kinase, présente 71% d'homologie avec l'unité Aurora B kinase et 60% d'homologie avec l'unité Aurora C kinase. La phosphorylation du résidu Thr288 conduit à des changements conformationnels qui permettent à la protéine d'activer son activité kinase [2].
D'autres changements conformationnels de la protéine comprennent le repliement des domaines C-terminal et N-terminal pour former le site de liaison de la protéine. Il est intéressant de noter qu'AURKA possède des liaisons hydrogène spécifiques entre l'adénosine et la charnière de l'unité structurale de kinase, qui peuvent être utilisées pour développer des inhibiteurs spécifiques d'Aurora A.
En ce qui concerne la localisation d'AURKA dans la cellule, cette protéine est généralement située près du centrosome. Aurora A est principalement active pendant les phases tardives G2 et tardives S du cycle cellulaire, et a son activité maximale en mitose [3]. Il existe plusieurs fonctions associées à la protéine, notamment : la maturation du centrosome, l'épigénétique, l'inhibition de l'assemblage tumoral, l'assemblage du fuseau, la régulation de l'entrée mitotique, etc.
La surexpression d'Aurora A se produit dans presque tous les types de tumeurs - elle a été trouvée dans 29 des 33 types de cancer. Selon différentes études, une telle surexpression provoque des instabilités génomiques et chromosomiques, un effet anti-apoptotique et une transition épithélio-mésenchymateuse. Il stimule la division cellulaire même si l'ADN des cellules est endommagé, ce qui entraîne une surpopulation de cellules anormales dans un organisme [4].
Aurore B
Aurora B, étant l'un des membres de la famille Aurora, a également trois unités structurelles, qui, à l'exception de l'unité N-terminale, sont homologues aux unités d'Aurora A. L'unité N-terminale, en revanche, est beaucoup plus courte - la L'unité Aurora A N-terminal est presque deux fois plus longue que l'unité Aurora B N-terminal. L'unité N-terminale d'AURKB contient également un promoteur auquel des facteurs de transcription tels que E2F1, E2F4, FOXM1 ou DP2 peuvent se lier pour réguler la transcription d'AURKB [5]. Comme AURKA, AURKB possède un résidu - Thr232 - qui modifie la conformation de la protéine après phosphorylation.
La localisation cellulaire de l'Aurora kinase B en tant que protéine passagère chromosomique diffère selon la phase actuelle du cycle cellulaire. Transporté par le fuseau et les microtubules astraux, on le retrouve également dans le cytoplasme et le cortex des cellules équatoriales.
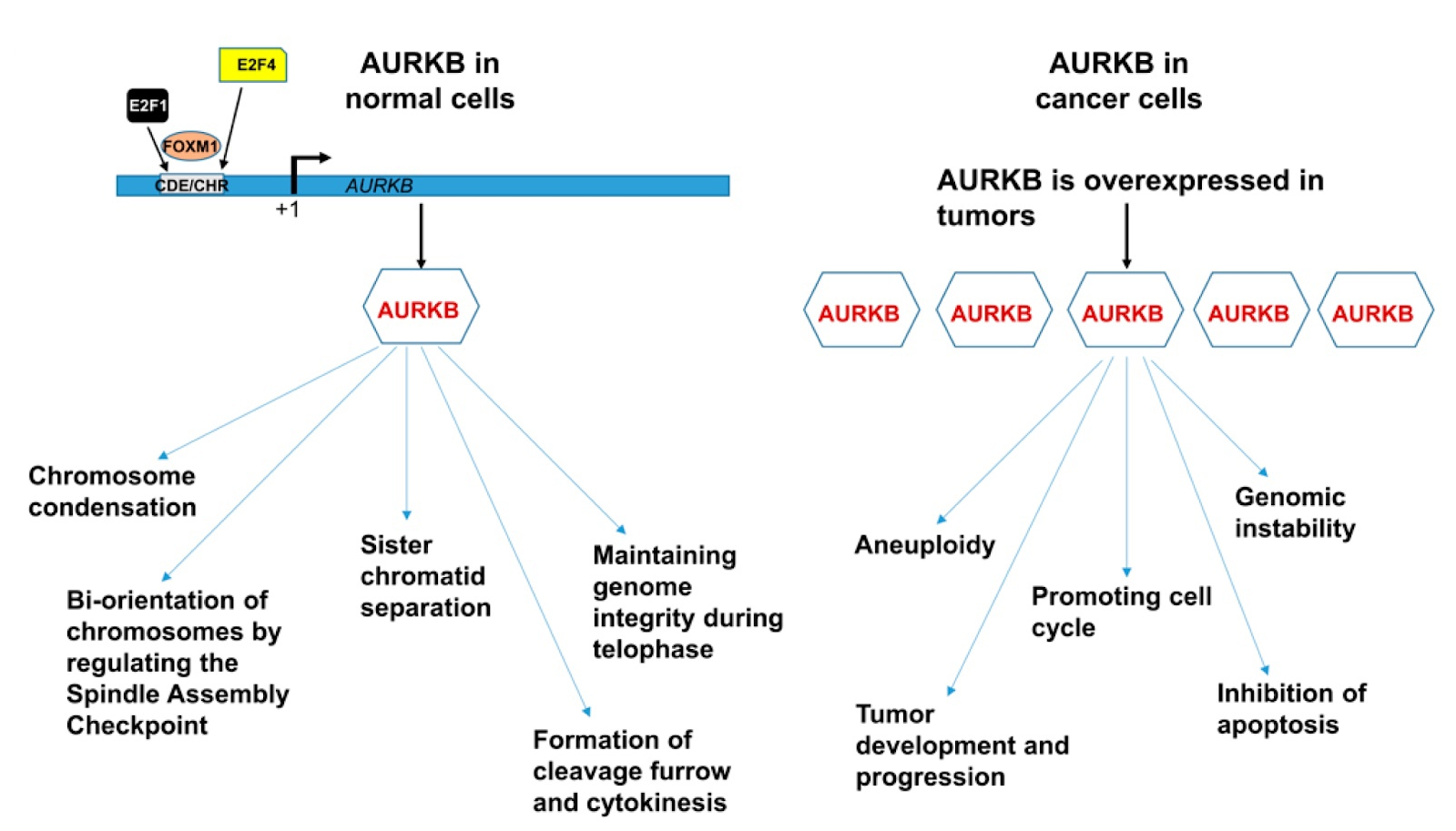
Figure 2. Rôle de l'Aurora kinase B dans les processus biologiques et dans le développement du cancer [5].
Les fonctions d'AURKB dans les cellules normales et leur rôle dans les cellules cancéreuses sont présentés dans la figure ci-dessus. Il a été découvert qu'Aurora B dans les tumeurs interagit avec plusieurs autres oncogènes et suppresseurs de tumeurs, y comprisles oncogènes Myc, l'oncoprotéine Bcr-Abl, la cycline K et le suppresseur de tumeur dépendant de p53 FBXW7.
Aurore C
Aurora C a une structure à trois domaines similaire à Aurora A et Aurora B. Cependant, en raison de l'épissage alternatif, son domaine N-terminal existe comme l'une des trois variantes illustrées dans la figure ci-dessous.
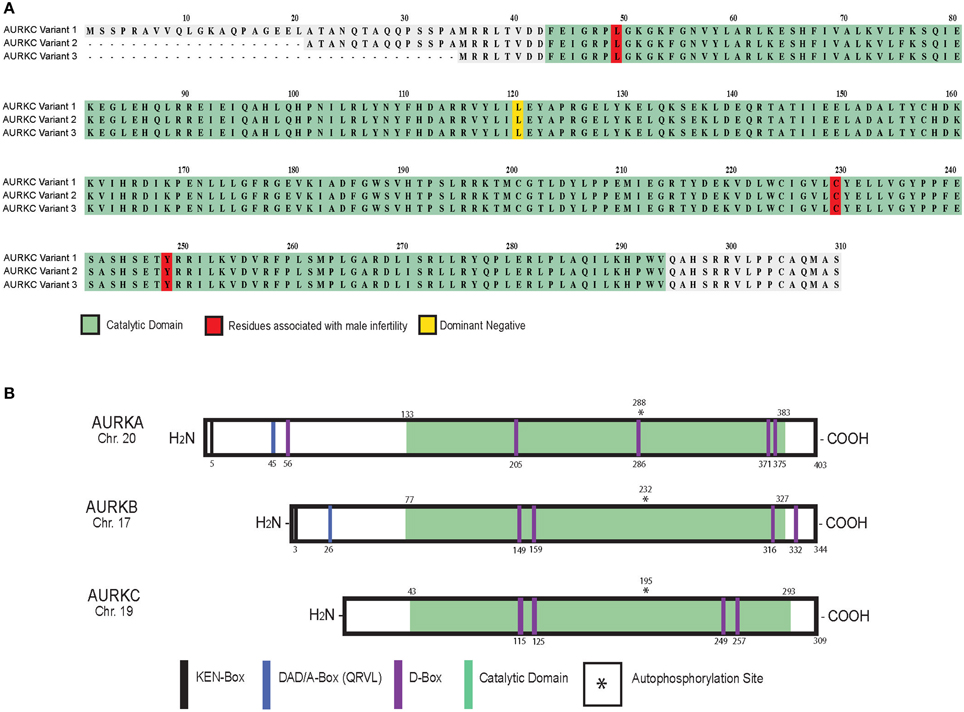
Figure 3. Variantes d'AURKC [6].
L'unité structurelle de kinase catalytique d'Aurora C a une homologie de 60% avec l'unité structurelle de kinase Aurora A, comme il a été indiqué précédemment, et une homologie assez élevée de 75% avec l'unité structurelle de kinase Aurora B [2]. Cela peut expliquer pourquoi Aurora B et C interagissent avec la même protéine centromère interne (INCENP) et ont une fonctionnalité similaire dans les processus biologiques.
Fait intéressant, alors qu'Aurora A et Aurora B sont présentes dans presque toutes les cellules d'un organisme, une expression considérable des protéines Aurora C se trouve dans les cellules en cours de méiose (spermatozoïdes et ovocytes). La fonction AURKC dépend de la localisation actuelle et de la phase du cycle cellulaire. La plupart des fonctions connues de la kinase Aurora C chevauchent les fonctions de la kinase Aurora B [6].
Malheureusement, à ce jour, on sait peu de choses sur le lien entre le cancer et les fonctions de la kinase Aurora C, bien que des niveaux élevés d'expression d'Aurora C soient détectés dans certaines tumeurs.
Inhibiteurs d'Aurora
La plupart des inhibiteurs Aurora ont été conçus pour inhiber les kinases Aurora A ou Aurora B. La raison en est qu'il existe beaucoup plus d'informations sur leur implication dans le développement du cancer et sur leurs fonctions et conformations en général. Nous passerons ici en revue les inhibiteurs d'Aurora les plus populaires, leurs cibles et leur mécanisme d'action.
Tableau 1. Inhibiteurs d'Aurora [5, 7] et leurs cibles.
|
Inhibiteur d'Aurora |
Aurore A |
Aurore B |
Aurore C |
|
Barasertib (AZD1152) |
- |
+ |
- |
|
Alisertib (MLN8237) |
+ |
- |
- |
|
Hespéradine |
- |
+ |
- |
|
Danusertib (PHA-739358) |
+ |
+ |
+ |
|
PF-03814735 |
+ |
+ |
- |
|
AMG900 |
+ |
+ |
+ |
|
SP-96 |
- |
+ |
- |
|
GSK1070916 |
- |
+ |
+ |
|
AT9283 |
+ |
+ |
- |
|
CYC116 |
+ |
+ |
- |
ChemDiv peut proposer une bibliothèque ciblée de kinases Aurora A-B contenant 10 000 composés qui présentent un mode de liaison similaire à celui des inhibiteurs Aurora rapportés.
Références :
- Fu J, Bian M, Jiang Q, Zhang C. "Rôles des kinases Aurora dans la mitose et la tumorigenèse". Mol Cancer Res. 2007 janvier;5(1):1-10.
- Willems E, Dedobbeleer M, Digregorio M, Lombard A, Lumapat PN, Rogister B. “La diversité fonctionnelle des kinases Aurora : une analyse complète critique". Cell Div. 2018 Sep 19;13:7.
- Naso FD, Boi D, Ascanelli C, Pamfil G, Lindon C, Paiardini A, Guarguaglini G. “Localisation nucléaire d'Aurora-A : sa régulation et son importance pour les fonctions d'Aurora-A dans le cancer". Oncogène. 2021 juin;40(23):3917-3928.
- Mou PK, Yang EJ, Shi C, Ren G, Tao S, Shim JS. «Aurora kinase A, une cible létale synthétique pour la médecine anticancéreuse de précision”. Exp Mol Med. 2021 Mai ;53(5):835-847.
- Borah NA, Reddy MM. «Inhibition de l'Aurora Kinase B : Une Stratégie Thérapeutique Potentielle pour le Cancer”. Molécules. 1 avril 2021;26(7):1981.
- Quartuccio SM, Schindler K. "Fonctions de l'Aurora kinase C dans la méiose et le cancer". Front Cell Dev Biol. 2015 août 20;3:50.
- Bavetsias V, Linardopoulos S. “Inhibiteurs d'Aurora Kinase : état actuel et perspectives”. Oncol avant. 21 décembre 2015;5:278.