DMSO
Applications du DMSO
Le diméthylsulfoxyde (DMSO) est un composé polaire chimique organique à l'état liquide dans des conditions normales. C'est le solvant aprotique ou le solvant qui, lorsqu'il se décompose en solution, ne forme pas d'ion hydrogène libre (proton). La substance est un liquide malade sans couleur et avec une odeur spécifique. Le composé est miscible avec l'eau, l'éthanol, le chloroforme et le benzène en toutes proportions. Il est également très soluble dans l'alcool diéthylique et l'acétone. Dans l'industrie, le diméthylsulfoxyde est produit par oxydation catalytique du sulfure de diméthyle (DMS) avec de l'oxygène ou par oxydation avec du dioxyde d'azote [1].
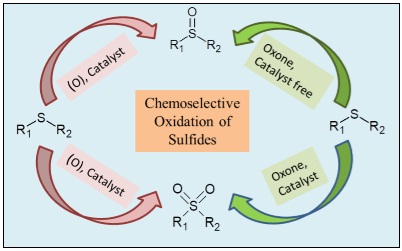
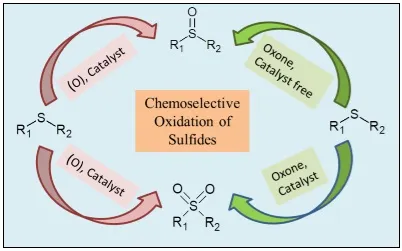
Figure 1. Représentation graphique de l'oxydation des sulfures [1].
D'autres propriétés physiques et chimiques du DMSO comprennent une température d'ébullition à 189 degrés Celsius (tableau 1) et une faible volatilité. Ces deux faits déterminent la possibilité d'utilisation du diméthylsulfoxyde comme solvant. De plus, de nos jours, le composé a de nombreuses autres applications qui seront examinées dans l'article.
DMSO comme solvant
Le DMSO est généralement utilisé comme solvant commercial dans l'industrie pharmaceutique depuis plus de six décennies. Plusieurs réactions chimiques spécifiques sont plus efficaces si elles sont effectuées dans une solution de DMSO, ce qui se traduit par un rendement de produit plus élevé. Les puissantes propriétés solubles du composé permettent de préparer des composants hautement concentrés dans des formulations agrochimiques.
Un point d'ébullition élevé (tableau 1) permet au DMSO d'avoir une vitesse d'évaporation lente. Cette propriété facilite l'utilisation du composé comme solvant dans les réactions chimiques nécessitant un chauffage. Le point de congélation élevé (environ 18 degrés Celsius, tableau 1), en revanche, peut limiter ses applications dans un certain nombre de procédés chimiques, même si cela signifie que le DMSO peut être stocké à température ambiante sans aucun problème.
Tableau 1. Propriétés du DMSO [2]
La polarité de solvant élevée du diméthylsulfoxyde facilite la dissolution d'autres composés polaires et non polaires. Bien sûr, il existe d'autres solvants aux caractéristiques similaires (telles que point d'ébullition élevé ou stabilisation d'intermédiaires chargés) : le diméthylacétamide, le diméthylformamide, le HMPT et la N-méthyl-2-pyrrolidone en sont des exemples. Cependant, toutes choses étant égales par ailleurs, le DMSO est nettement moins toxique. Les doses létales de diméthylsulfoxyde administrées par voie topique, orale ou parentérale aux animaux de laboratoire sont élevées [3].
Comme tout autre solvant, le diméthylsulfoxyde a ses propres limites d'utilisation. De nos jours, la solubilité dans le DMSO est l'un des paramètres requis pour les tests de criblage à haut débit (HTS). Des méthodes d'apprentissage automatique ont été utilisées pour classer les molécules comme solubles et non solubles dans le DMSO [4]. L'une des raisons pour lesquelles le DMSO a des difficultés en tant que solvant est qu'il n'est pas inerte. Ce composé dans plusieurs conditions spécifiques devient une partie de la réaction chimique elle-même - et les gens ont trouvé des applications dans ce fait !
Applications du DMSO dans la recherche
Le diméthylsulfoxyde, comme indiqué précédemment, peut participer activement aux réactions chimiques, il est donc utilisé dans la recherche chimique et biologique. Le composé est connu pour réguler de nombreux mécanismes moléculaires dans la cellule : la réplication de l'ADN, la recombinaison et la régulation de l'expression génique sont parmi les plus populaires [5]. Par conséquent, il est utilisé dans la réaction en chaîne par polymérase (PCR) pour améliorer l'amplification par PCR en empêchant le réannelage de l'ADN dénaturé afin que les amorces puissent se lier à leurs emplacements complémentaires corrects.
Une autre approche bien connue du DMSO dans la recherche scientifique est celle de cryoprotecteur pour les cultures cellulaires. En raison de la présence de diméthylsulfoxyde dans le milieu de congélation cellulaire, les cristaux de glace intracellulaires et extracellulaires ne se développent pas tout au long du processus de congélation cellulaire. Cela empêche la destruction et la mort des cellules et est généralement utilisé pour le stockage des cellules.
DMSO en tant que docteureuh
La recherche sur le diméthylsulfoxyde en tant que médicament potentiel a commencé en 1961, lorsque le dr. Stanley W. Jacob, MD, a découvert sa capacité à pénétrer à travers les membranes cellulaires avec peu ou pas de résistance. La découverte a été suivie d'autres études sur le médicament qui ont montré la capacité du DMSO à transporter d'autres molécules à travers les membranes. Ce fait a fait du composé l'un des systèmes d'administration de médicaments possibles.
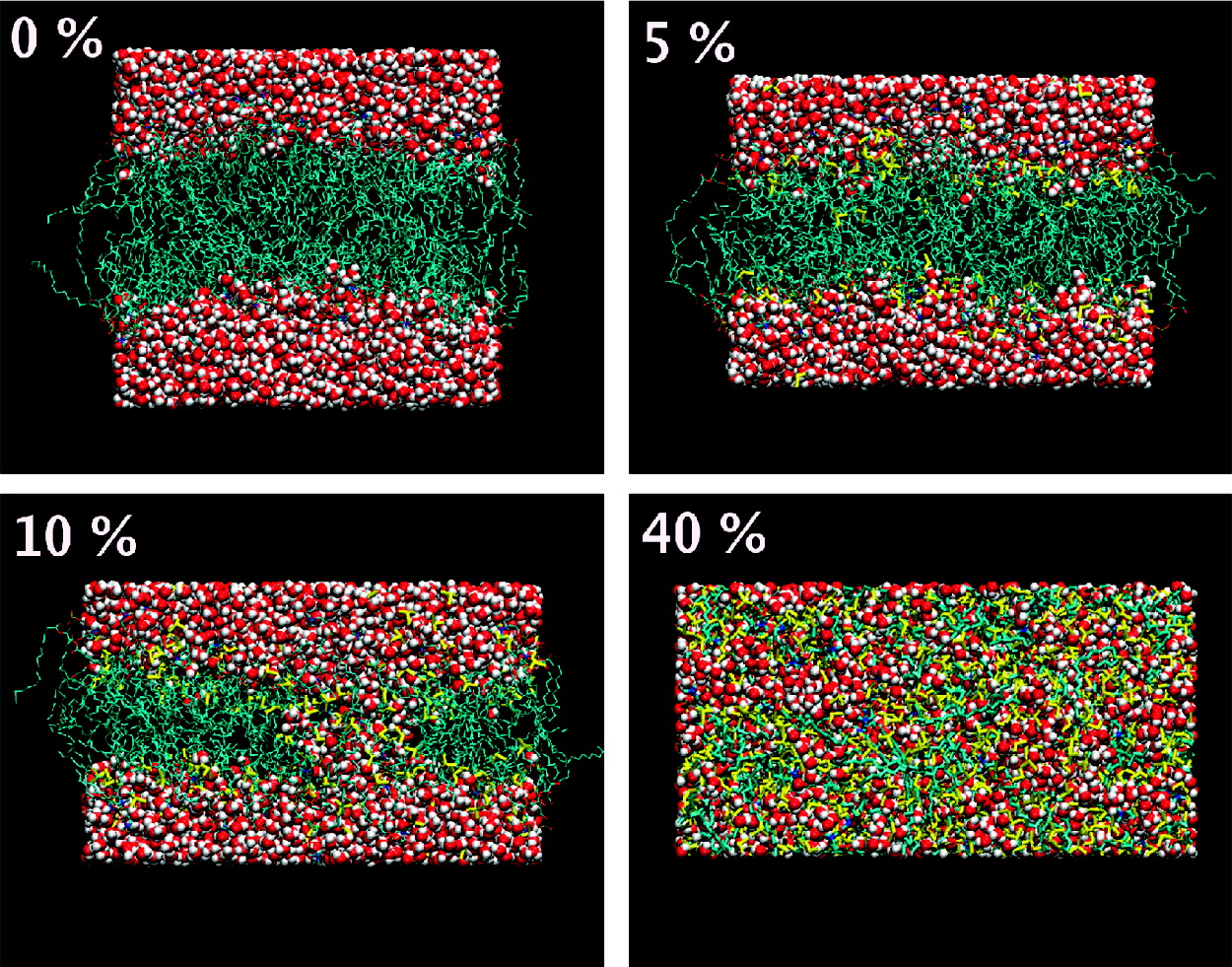
Figure 1. Modes d'action distincts du diméthylsulfoxyde sur les membranes phospholipidiques en fonction du % de DMSO (base sans lipides). Les lipides sont représentés en couleur cyan, l'eau en couleur rouge et le DMSO en couleur jaune. [6]
Depuis lors, des études sur le DMSO comme traitement de diverses maladies ont été menées. De nos jours, la Food and Drug Administration (FDA) a approuvé le médicament uniquement comme conservateur d'organes pour la transplantation et pour la cystite interstitielle. Cependant, la recherche scientifique a montré ses applications dans la réduction de la douleur, la dentisterie, l'oncologie, la virologie, la dermatovénérologie, l'urologie, etc. [7]
Pour conclure, le DMSO est un bon solvant avec plein d'autres usages. Les composés chimiques de ChemDiv sont dissous dans du DMSO pour être livrés, offrant un stockage sûr et à long terme.
Références
-
En ligneKupwade, R. (2019). Un examen concis de la synthèse des sulfoxydes et des sulfones avec une référence particulière à l'oxydation des sulfures. Journal des revues chimiques. 1.
-
Xiang, J.-C., Gao, Q.-H., & Wu, A.-X. (2017). Les applications du DMSO. Solvants comme réactifs dans la synthèse organique, 315–353.
-
Brayton, C.F. (1986). Diméthylsulfoxyde (DMSO): une revue. Le vétérinaire Cornell, 76(1), 61–90.
-
Tetko, I.V., Novotarskyi, S., Sushko, I., Ivanov, V., Petrenko, A.E., Dieden, R., … Mathieu, B. (2013). Développement de modèles de solubilité du diméthylsulfoxyde à l'aide de 163 000 molécules : utilisation d'une métrique d'applicabilité de domaine pour sélectionner des prédictions plus fiables. Journal d'information chimique et de modélisation, 53(8), 1990–2000.
-
Lv, B., Dai, Y., Liu, J., Zhuge, Q., & Li, D. (2015). L'effet du diméthylsulfoxyde sur la relaxation de l'ADN superenroulé catalysée par les topoisomérases de type I. BioMed Research International, 1–8.
-
Gurtovenko, A. A., & Anwar, J. (2007). Modulation de la structure et des propriétés des membranes cellulaires : le mécanisme d'action moléculaire du diméthylsulfoxyde. Le Journal of Physical Chemistry B, 111(35), 10453–10460.
-
Shulyak, A., Goydyk, V., Gusakovsky, S., Grygorenko, V., Mytsyk, Y., & En ligneBadiuk, N. (2021). Aspects modernes de l'utilisation du diméthylsulfoxyde (DMSO). Pharmacologie en ligne, 1, 82-89.