アロステリック阻害剤
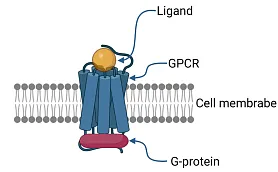
アロステリック阻害剤とその応用の可能性
アロステリーの歴史
協調タンパク質のリガンドが異なる部位に結合するという最初の既知の発見は、1904 年にデンマークの医師クリスチャン ボーアによって行われました。 1]。 1961 年、Jacques Monod と Francois Jacob は、この種の調節を「アロステリック」阻害と名付けました。これは、活性部位ではなく、酵素表面の離れた領域に結合するためです [2]。
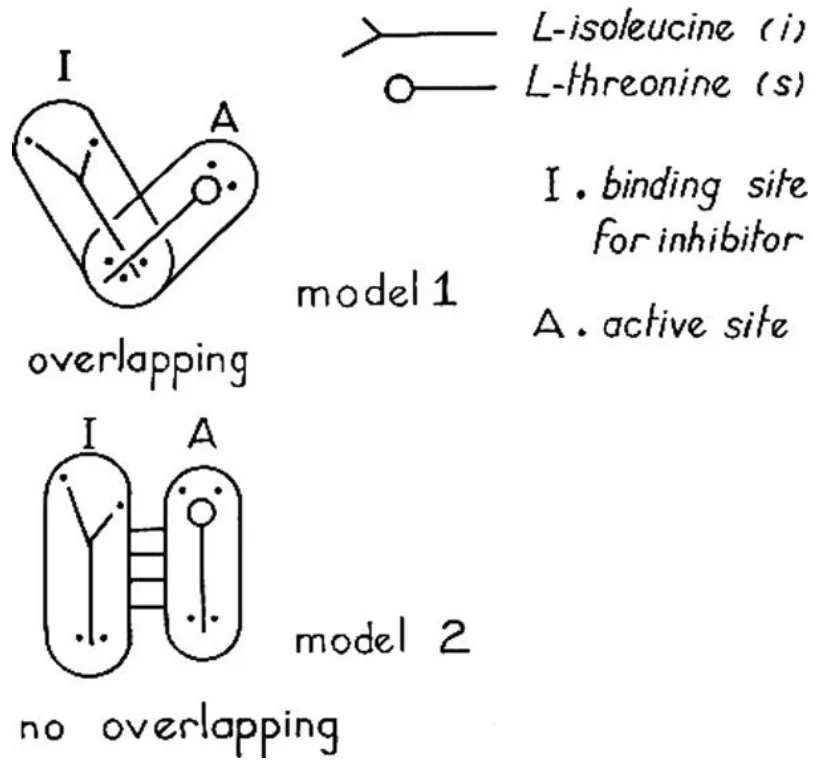
図 1. Jean-Pierre Changeux [2] による、L-イソロイシンによる L-スレオニン デアミナーゼ調節の 2 つの異なるモデル。 2 番目のモデルは、2 つの離れた部位 (1 つは阻害剤用、もう 1 つは基質用) を表しています。 その後の出版物で、ジャック・モノーとフランソワ・ジャコブは、この種の規則を「アロステリック」と名付けました。
アロステリック阻害剤に基づく最初の薬剤は、2004 年に米国 FDA によって承認されました。それ以来、この「間接的な」タイプの阻害剤の人気が急速に高まっています [3]。 今日、アロステリック阻害剤が薬物として使用されているいくつかのケースを次に示します。
- ジアゼパム – 不安、パニック発作、発作などの治療に使用される薬。 <リ> マラビロック – HIV 感染症の治療に使用される抗ウイルス薬。 <リ> シナカルセト – 副甲状腺癌、HPT の治療に使用される薬剤。
阻害の概要
酵素またはタンパク質の阻害剤は、触媒作用のプロセスを妨害し、酵素の化学変化を遅らせる化合物です。 細胞内の酵素反応の蔓延は、阻害剤の薬物としての使用の人気の理由です. 研究者は阻害剤の 2 つの主なクラスを区別します。 最初は化学反応を遅くするために可逆的と呼ばれますが、不可逆的は化学反応を完全に停止します.
別の阻害分類は、酵素との相互作用に基づいています。 それによると、阻害剤は、競合的、非競合的、および混合阻害剤の 3 つの主なグループに分けることができます (表 1)。
表 1. 3 種類の酵素阻害 [4]。
<テーブル> <本体>
タイプ
競争力
競争力がない
混合
バインド
エンザイム
酵素基質複合体
酵素または酵素基質複合体
サイト
オルソステリック/アロステリック
アロステリック
アロステリック
図式
競合阻害剤は、酵素表面の同じ相互作用領域 (いわゆる活性部位) で基質と競合します。 これらの阻害剤のほとんどは、基質のような分子構造を持っています。 しかし、阻害剤と複合体を形成する酵素は、阻害がない場合ほど効果的に化学変換を触媒することはできません。
非競合的で混合された阻害剤は、活性のある基質が結合する酵素とは異なる酵素の遠い部位と結合を形成します(アロステリック部位とも呼ばれます)。 非競合的阻害剤は、酵素-基質複合体が形成された後、酵素の離れた部位と相互作用します。 対照的に、混合阻害剤は、複合体および酵素自体と相互作用することができます。 基質がすでに結合している、または結合していない酵素への結合に対する親和性は、阻害剤によって異なります。 これらの状態の両方に対する親和性が等しい化合物のグループは、非競合的阻害剤として知られています。
阻害剤の非競合的グループと混合グループの両方がアロステリック阻害剤のより大きなグループに属していることは明らかですが、アロステリック競合的阻害剤はありますか? 驚いたことに、はい! 基質との活性部位の競合には、それに付着する必要はありません。 実際、いくつかの競合的阻害剤は、アロステリック サイトを介してタンパク質の状態の変化を制御します [5]。 この場合、そのような種類の阻害剤が競合する唯一の要件は、阻害剤がそのアロステリック部位に結合しているのと同時に、基質が酵素に結合していないことです.
アロステリック阻害とオルソステリック阻害
アロステリック (間接) 調節の基本は既にわかっているので、それをオルソステリック (活性部位に直接) 阻害と比較して、その利点を考えてみましょう。
まず第一に、アロステリック阻害は、それが酵素に影響を与える方法と時期においてより多くの変動性を持っています. タンパク質表面の活性部位とは異なる領域との相互作用は、酵素活性を完全に阻害するだけでなく (オルソステリック阻害の場合のように)、それを調節することもできます [6]。 さらに、多くのアロステリックモジュレーターは、基質の結合後に酵素と相互作用できますが、オルソステリック阻害剤は、結合するための遊離活性部位を必要とします。
第二に、酵素の活性部位は非常に保存的です。 これにより、標的ではなく類似の活性部位を持つ相同タンパク質に結合するオルソステリック薬物が導かれます [7]。 非標的活性は、薬の有効性を低下させるだけでなく、深刻な副作用を引き起こす可能性があります. 反対に、アロステリック薬はより保存性の低い表面領域に結合するため、特異性が高くなります。
最後に、最も知られているオルソステリック阻害剤は、酵素の活性部位を機械的にブロックし、基質の相互作用の場所を占有します。 基質の濃度が何らかの形で増加すると、同じ部位に付着する薬物の効果が低下する可能性があります。 一方、アロステリック阻害剤は、このような問題を回避でき、その効率は高濃度の基質によって影響を受けません [8]。
要約すると、アロステリック阻害剤は、タンパク質との通常とは異なる方法で相互作用します。 多くの場合、それらは他の阻害剤よりも安全で効果的な選択肢です。 現在、その使用範囲は非常に広く、拡大中です! ChemDiv の Allosteric Kinases Inhibitors Library には 26,000 の化合物が含まれており、上記のすべての問題によって制限されている現在のオルソステリック阻害剤の有望な代替品です。
参考文献:
<オール>